日本:全球首款光免疫療法藥物獲批,癌癥新療法—光免疫療法有望加速
關(guān)于光免疫療法,日本就醫(yī)網(wǎng)從2018年開始一直在跟蹤報道。作為術(shù)手,放療、化療和免疫治療之后的“第種五治療方法”,光免疫療法自提出以來一直備受關(guān)注。
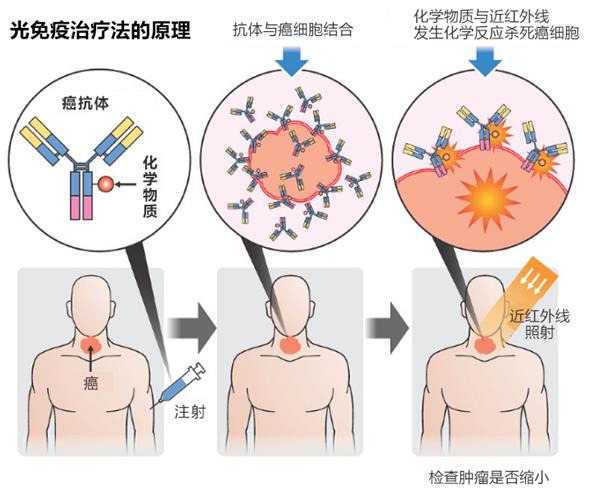
該療法由美國國立衛(wèi)生研究院(NIH)主任研究員小林久隆團隊開發(fā),其基本原理是:給患者注射可與近紅外線反應的特殊光免疫藥物,該藥物會與癌細胞特有的蛋白質(zhì)(抗體)結(jié)合,然后經(jīng)體外或通過內(nèi)窺鏡利用近紅外線照射腫瘤病灶,光線會破壞已經(jīng)與化學物質(zhì)結(jié)合的癌細胞的細胞膜,從而滅殺癌細胞。
此前,光免疫療法已經(jīng)進入臨床試驗,主要用于頭頸部腫瘤的治療。近日再傳佳報,全球首款光免疫療法藥物—Akalux®(學名:Cetuximab Saratolacan Sdoium,簡稱Akalux®)在日本獲批,用于治療頭頸部惡性腫瘤。該藥物由日本樂天醫(yī)藥研發(fā),已經(jīng)于2020年9月下旬獲得日本厚生勞動省的生產(chǎn)及銷售許可,可用于「無法切除的局部晚期或局部復發(fā)性頭頸癌」。與此藥物搭配使用的「BioBlade® Laser System」(簡稱“BioBlade®”)的生產(chǎn)及銷售許可也于2020年9月2日獲批。早在去年4月,日本厚生勞動省將Akalux®列為先行審查指定項目(SAKIGAKE) ;而今年3月,樂天醫(yī)藥正式提出申請。如今,日本將成為首個獲得核準制造和銷售Akalux®的國家。
日本于2017年引入光免疫治療臨床試驗,小林久隆團隊與日本樂天醫(yī)藥正在共同研發(fā)一種名為Illuminox™的治療技術(shù)平臺,基于光免疫治療的治療原理,可以選擇性地將光敏劑(即光免疫藥物)攜帶到特定細胞,再透過照射光線來選擇性地殺死癌細胞。以Illuminox™平臺為基礎(chǔ)所開發(fā)的第一種治療方法為Akalux®和BioBlade®。
據(jù)悉,本次獲批是基于針對局部復發(fā)性頭頸癌的國外I / IIa期臨床試驗(39例)和日本I期臨床試驗(3例)的結(jié)果。在IIa期臨床試驗中,最佳緩解率為43.3%,其中4例(13.3%)完全緩解,9例(30.0%)部分緩解。在日本I期臨床研究中,經(jīng)中央獨立審查判斷的緩解率為66.7%(2位),均為部分緩解。
在日本,一般而言,醫(yī)藥品獲得認可后將在60-90天內(nèi)確定藥物價格,并被收錄進醫(yī)療保險范圍之中。也就是說,預計最快今年內(nèi),可以在日本的醫(yī)院內(nèi)使用Akalux治療。日本就醫(yī)網(wǎng)也會一如既往的關(guān)注光免疫療法,及時分享最新動態(tài)。


