2019,基因治療實現突破的一年

維多利亞·格雷(VictoriaGray)的血被抽出,以便醫生可以找到導致她患病的原因:骨髓中的干細胞正在制造變形的紅細胞。今年夏天,納什維爾的這位患有看似無法治愈的遺傳疾病的母親終于通過編輯基因組找到了脫離苦難的辦法。
這位34歲的年輕人在一封電子郵件中告訴法新社,我從11歲起就希望能夠治愈。在數周的時間里,醫生找到了引起她病的原因,骨髓中的干細胞被送到蘇格蘭的一家實驗室,在那里,他們通過CRISPR進行了基因修飾,這種新工具被非正式地稱為“分子剪刀”。
經過基因編輯的細胞被輸回格雷的靜脈和骨髓。一個月后,她恢復了正常的血細胞。醫護人員說,謹慎是必要的,但從理論上講,她已經被治愈。
“這是該治療方法的早期結果,我們仍舊需要看看在其他患者中如何發揮作用,但是這些結果確實令人興奮。”納什維爾薩拉·坎農研究所的醫生海達爾·弗朗古爾說。
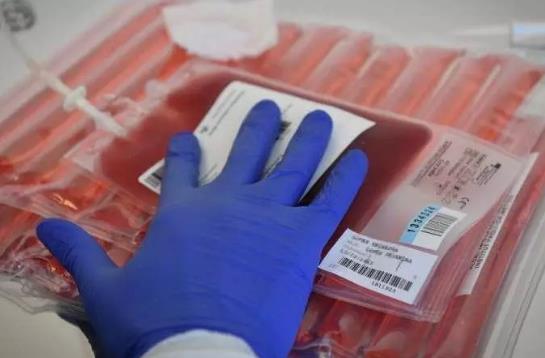
在德國,一名19歲女性接受了另一種血液疾病β地中海貧血的相似治療。她以前每年需要輸血16次。九個月后,她完全擺脫了疾病的困擾。
CRISPR使基因編輯的使用更加廣泛,它比以前的技術簡單得多,便宜且易于在小型實驗室中使用。CRISPR的發明者之一法國遺傳學家EmmanuelleCharpentier說:“這一切發展很快。”該生物技術公司進行了Gray和德國患者的臨床試驗。
對治療的意義
克里斯普(CRISPR)是基因治療取得重大進展的的最新突破。這項醫學冒險始于三十年前,當時一部電視轉播節目正在為患有肌營養不良癥的兒童籌集資金。這是一次醫學冒險,實踐該技術的科學家將正常基因插入含有缺陷基因的細胞中,該工具無需添加基因,而是可以編輯基因組本身。
經過數十年的研究,研究了針對遺傳疾病的修復方法,并在2019年見證了一個歷史性的里程碑:批準在美國用于神經肌肉疾病和在歐盟用于血液疾病的首個基因療法推向市場。
他們加入了其他幾種基因療法,最近幾年將其總數增加到八種,可以治療某些癌癥和遺傳性失明。

法國肌肉營養不良癥協會的科學總監SergeBraun將2019年視為轉折點,將引發一場醫學革命。他在巴黎告訴法新社,“基因治療花了一代人的時間才成為現實。現在,它只會發展得更快。”
就在華盛頓郊外,美國國立衛生研究院(NIH)的研究人員也在慶祝“突破期”。NIH科學政策副主任CarrieWolinetz說:“我們已經到了一個拐點。”然而,這些療法的價格過高,高達200萬美元,這意味著患者將面臨與保險公司進行艱難的談判。

法國遺傳學家EmmanuelleCharpentier不相信基因療法可能帶來的更多反人類情況。她舉例說,格雷在醫院花了幾個月的時間抽血,進行化療,編輯了通過輸血重新引入的干細胞,并與感染作斗爭,她不能在離家很近的社區醫院做這項治療。
根據麻省理工學院的研究人員的預測,到2022年,批準的基因療法的數量將增加到40種左右。它們將主要針對影響肌肉,眼睛和神經系統的癌癥和疾病。
業界的擔憂
去年,在中國,科學家何建奎(HenJiani)使用Crispr創造了他所謂的第一批基因編輯的人類,從而引發了國際丑聞,并引起了科學界的驅逐。

中國科學家何建奎使用CRISPR創造了他所謂的第一個基因編輯的人類。這位生物物理學家說,他已經改變了人類胚胎的DNA,誕生了雙胞胎女孩Lulu和Nana,他的目標是創造一種突變,以防止女孩感染艾滋病毒。
賓夕法尼亞大學的遺傳學教授基蘭·穆蘇努魯(KiranMusunuru)說:“這種技術并不安全。CRISPR經常在目標基因旁邊切割,從而導致意想不到的突變。”Musunuru補充說:“如果您不關心后果,這很容易做到。”
生物學家DenisRebrikov曾在俄羅斯表示,他希望利用Crispr幫助聾啞父母生下沒有殘疾的孩子。
科學界還存在對動物進行基因編輯的誘惑,例如布基納法索的引起瘧疾的蚊子或美國帶有攜帶萊姆病的壁虱的小鼠。

2016年7月20日在法國Maison-Alfort國家農業科學研究所(INRA)上拍攝的照片顯示了一種蟲,其叮咬可能傳播萊姆病但是,負責這些項目的研究人員正在謹慎推進,但他們充分意識到生態系統中連鎖反應的不可預測性。
Charpentier認為基因療法不會出現很多反人類的情況,包括美國的“生物黑客”向他們購買了在線購買的Crispr技術。她說:“并不是每個人都是生物學家或科學家。生物技術通常傾向于變得更好,我是一名細菌學家,多年來我們一直在談論生物恐怖主義,但什么都沒發生。”


