腸癌在不到芝麻粒大的時候,就很大可能已經(jīng)轉(zhuǎn)移到肝或大腦了
斯坦福大學(xué)醫(yī)學(xué)院的醫(yī)學(xué)和遺傳學(xué)助理教授Christina Curtis聯(lián)合其他4所研究機(jī)構(gòu),分析了近3000名患者的基因數(shù)據(jù),通過三維計算機(jī)模擬分析,發(fā)現(xiàn)高達(dá)80%的轉(zhuǎn)移性結(jié)直腸癌,可能在原始腫瘤長到不到芝麻粒大小(約0.01立方厘米,100萬個癌細(xì)胞)的時候,就擴(kuò)散到體內(nèi)的其他地方了,而且這個大小目前在臨床上是檢測不到的。這是近日發(fā)表在著名期刊《自然·遺傳學(xué)》上的研究。

▲ Christina Curtis
“這一發(fā)現(xiàn)非常令人驚訝,”Christina Curtis博士說。“這表明癌癥在誕生之初就獲得了轉(zhuǎn)移能力。顯然,我們的結(jié)論與轉(zhuǎn)移發(fā)生在癌癥晚期這個流行假設(shè)相反,會對患者分期、治療和早期檢測產(chǎn)生一定的影響。”
進(jìn)入21世紀(jì),我們都認(rèn)為癌癥是一種基因病,癌細(xì)胞的產(chǎn)生和轉(zhuǎn)移,是體細(xì)胞逐漸積累基因突變導(dǎo)致的,因此主流觀點認(rèn)為,當(dāng)腫瘤發(fā)展到一定程度之后,會有一部分細(xì)胞獲得轉(zhuǎn)移的能力。
然而,近年來,已經(jīng)有研究人員在早期乳腺腫瘤患者體內(nèi)發(fā)現(xiàn)擴(kuò)散出去的腫瘤細(xì)胞,在早期乳腺癌和胰腺癌的小鼠模型中,研究人員也發(fā)現(xiàn)了播散出去的腫瘤細(xì)胞。
這就讓一些研究人員對主流觀點產(chǎn)生了質(zhì)疑。還有一些科學(xué)家被這些新發(fā)現(xiàn)吸引,他們想知道,如果癌細(xì)胞能在腫瘤形成的早期就開始擴(kuò)散,那么究竟有多早呢?觸發(fā)的機(jī)制又是什么呢?要解答上面的問題,科學(xué)家必須同時研究原發(fā)病灶的腫瘤和轉(zhuǎn)移灶的腫瘤。然而,同時在大量患者身上獲取兩處腫瘤組織有一定的難度,因此,目前還沒有研究能評估人類癌癥的轉(zhuǎn)移時間。
Christina Curtis博士團(tuán)隊將寶壓在了腸癌上。腸癌發(fā)病率和死亡率都比較高,且研究的比較多,因此腸癌的驅(qū)動基因與疾病發(fā)展之間的關(guān)系也相對比較清楚。而且腸癌的主要轉(zhuǎn)移對象肝臟,和罕見轉(zhuǎn)移對象大腦,也能通過切除獲取轉(zhuǎn)移灶腫瘤組織。
雖然目前腸癌轉(zhuǎn)移的主流模型也是腫瘤經(jīng)過一系列的克隆進(jìn)化之后,到晚期才轉(zhuǎn)移。但是也有數(shù)據(jù)證明,腸癌也是“天生的壞種”,在腫瘤誕生的早期就具備了轉(zhuǎn)移的能力。
研究人員在多個研究隊列中,找到23例存在肝轉(zhuǎn)移或者腦轉(zhuǎn)移的腸癌患者。其中10例腦轉(zhuǎn)移患者有72份組織活檢樣本,13例肝轉(zhuǎn)移患者有46份組織活檢樣本。研究人員給這118個組織樣本做了全外顯子基因組測序分析,以便從中發(fā)現(xiàn)腸癌轉(zhuǎn)移的路徑和時間。
研究人員將原發(fā)灶與轉(zhuǎn)移灶的基因突變做了個比對,發(fā)現(xiàn)原發(fā)灶和轉(zhuǎn)移灶的癌癥驅(qū)動基因之間保持了高度的一致性。KRAS,TP53,SMAD4等的突變在原發(fā)性和轉(zhuǎn)移性腫瘤也是一致的。此外,這兩處的腫瘤也可能共享SNV和小插入缺失。
基于上面的基因變異數(shù)據(jù),研究人員給每位患者的腫瘤發(fā)展歷程做了個進(jìn)化樹,這就相當(dāng)于給癌細(xì)胞做了個家譜,看看他們一代代是如何傳遞下去的。
基于這些進(jìn)化樹,研究人員清晰地發(fā)現(xiàn),在可以分析的21名患者中,有17名患者的轉(zhuǎn)移灶是從一小撮癌細(xì)胞,甚至是一個癌細(xì)胞發(fā)育而來,而且從整個進(jìn)化樹來看,這些形成轉(zhuǎn)移灶的細(xì)胞形成于腫瘤發(fā)展的早期。這就暗示,在腸癌誕生的初期,這些形成轉(zhuǎn)移灶的癌細(xì)胞就離家出走了。
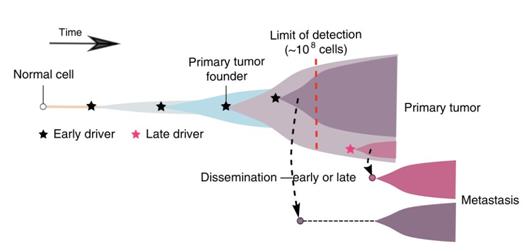
▲ 腸癌發(fā)家史
那這個早期到底是多早呢?或者換個更直觀的說法:癌細(xì)胞開始離家出走的時候,腫瘤有多大呢?
對于這個問題,目前這個進(jìn)化樹模型是難以回答的。不過這也難不倒在計算生物學(xué)方面受過專業(yè)訓(xùn)練的Christina Curtis博士。她帶領(lǐng)團(tuán)隊開發(fā)了一個三維計算模型,這個模型可以模擬在不同的參數(shù)條件下腫瘤的大小,及其與疾病進(jìn)展和基因變異之間的關(guān)系。
有了這個模型,他們很快就算出了21名患者癌細(xì)胞轉(zhuǎn)移時的腫瘤大小。結(jié)果,那17名(83%)早期轉(zhuǎn)移的患者,轉(zhuǎn)移的真是非常早啊。在腸道腫瘤體積不足0.01立方厘米,也就是不到100萬個細(xì)胞的時候,一部分癌細(xì)胞就已經(jīng)離家出走了。甚至有4名患者,在腫瘤只有1萬個細(xì)胞,體積只有0.0001立方厘米的時候,就轉(zhuǎn)移了。。。
從理論上講,體積小于0.01立方厘米的腫瘤,在臨床上是檢測不到的。這就意味著,對于那17位患者而言,幾乎是腫瘤一誕生,就是晚期。這些癌細(xì)胞那真是配得上“天生的壞種”這個稱呼。
研究人員又調(diào)用了MSK-Impact和GENIE研究中2751名腸癌患者的測序數(shù)據(jù)。這2751名患者診斷結(jié)果明確,有938名患者為IV期轉(zhuǎn)移性腸癌患者,另外的1813名患者為I-III期的早期腸癌患者;此外,這些患者的基因變異數(shù)據(jù)也比較完整。
將這些數(shù)據(jù)與上面的結(jié)果相結(jié)合,研究人員有了不小的發(fā)現(xiàn)。
“我們發(fā)現(xiàn)特定的突變組合可以預(yù)測轉(zhuǎn)移,”Christina Curtis博士說。例如,一個名為PTPRT的基因突變與經(jīng)典結(jié)直腸癌驅(qū)動基因的突變相結(jié)合,幾乎只在轉(zhuǎn)移性癌癥患者中出現(xiàn)。
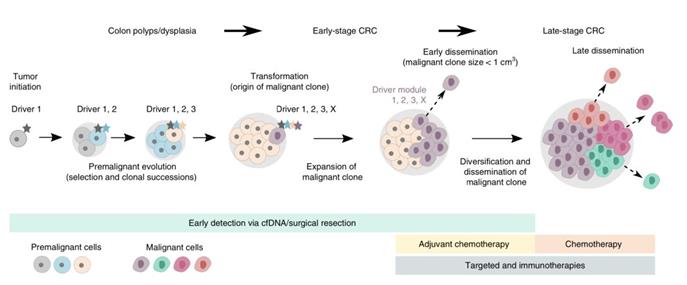
▲ 腸癌的進(jìn)化轉(zhuǎn)移史
之前有研究表明,PTPRT功能的喪失會增加一個名為STAT3蛋白的活性,從而增強(qiáng)了細(xì)胞的存活能力,因此STAT3有可能是個不錯的抗癌靶點。
此外,PTPRT的基因突變或許還可以用于指導(dǎo)患者的治療。如果切下的早期腫瘤中發(fā)現(xiàn)這個基因變異,或許可以考慮全身輔助化療。當(dāng)然,這個還需要臨床研究去驗證。


